Anti-cancer:がん腫瘍崩壊薬
研究背景
2022年6月の国立研究開発法人 国立がん研究センターがん統計によると日本人の2人に1人ががんと診断され、男性の4人に1人、女性の6人に1人ががんで死亡している(出典)。
- 2020年にがんで死亡した人:378,385人(男性220,989人、女性157,396人)
- 2009~2011年にがんと診断された人の5年相対生存率:男女計で64.1 %(男性62.0 %、女性66.9 %)
- 日本人が一生のうちにがんと診断される確率(2018年データに基づく):男性65.0%(2人に1人)、女性50.2%(2人に1人)
- 日本人ががんで死亡する確率(2020年のデータに基づく):男性26.7%(4人に1人)、女性17.9%(6人に1人)
そのため、これまでに数多くのがん治療法および治療薬の開発が行われ、さらに今でも新しい治療法や治療薬の開発が積極的に進められている。最新のがん治療法である免疫療法には、2018年にノーベル医学・生理学賞を受賞された京都大学特別教授の本庶佑先生が多大な貢献をされている。本庶佑先生の成果をもとに小野薬品工業が開発した「オプジーボ」が皮膚がんや肺がんなどの治療に使われることにより、多くの治療効果を上げている。免疫療法を含め最新のがん治療には以下の4種類がある。
- 手術療法
- 放射線療法
- 化学療法
- 免疫療法
がん化学療法の問題点
本研究ではこれらがんの治療法のなかで化学療法に着目した。がんの化学療法は歴史も長く非常に効果的な治療法であるが、がんの種類によって効果に大きな差があることが知られており、血液がん(白血病、悪性リンパ腫など)には効果が期待できる。血液がんの細胞は腫瘍のような細胞塊を形成せず、がん細胞が一つ一つが個別に血液中に存在している。
一方、がん細胞が細胞塊を形成する固形がんに対して十分な効果が得られているとは言えない。固形がんは上皮細胞にできる「上皮細胞がん」とそれ以外の「非上皮細胞がん」の2つに大別される。上皮細胞がんには、肺がん・乳がん・胃がん・大腸がん・肝がんなどがあり、非上皮細胞がんには、骨肉腫・軟骨肉腫・横紋筋肉腫・平滑筋肉腫などがある。
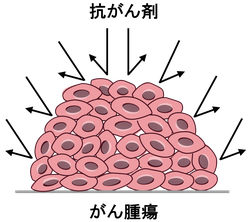
そこで、がんの化学療法のなかでも固形がんに対して抗がん剤が作用しにくい問題に焦点をあてた。固形がん腫瘍に抗がん剤が作用しにくい原因の1つに『がん腫瘍内部へ抗がん剤が送達されにくい』ことがある。がん腫瘍は細胞がお互いに密に接着しており抗がん剤が腫瘍深部まで浸透しにくい。つまり、腫瘍外周では殺細胞活性を示す適切な抗がん剤濃度が保たれていても、腫瘍深部にいくに従い抗がん剤の濃度の低下が避けられない(右図)。
よって、抗がん剤を投与しても腫瘍外周部のがん細胞は死滅するが、腫瘍中心部に存在するがん幹細胞(がん細胞のもとになる未分化ながん細胞(詳細))は残存してしまい、がんの再発を引き起こす。
研究戦略

固形がん腫瘍は細胞がお互いに密に接着しており抗がん剤が腫瘍深部まで浸透しにくいため、十分な治療効果が得られない。そこで、抗がん剤を作用させる前に、がん腫瘍を形成するがん細胞同士の接着を不全とすることによって、がん腫瘍を形成する細胞接着をルーズにする、または腫瘍を崩壊させることができれば、がん腫瘍中心部に抗がん剤を到達させることができると考えた。
細胞接着不全状態のがん腫瘍にできれば、抗がん剤が腫瘍の深部まで浸透し劇的に治療効果が高まると考えられる。さらに、腫瘍深部に存在するがん幹細胞も障害することができ、がんの再発防止にも効果が期待できる。本研究戦略は既存の抗がん剤の効果を高めるものであり、抗がん剤の投与量を減らすことにつながり、化学療法の副作用低減にも寄与できる。
細胞接着と細胞表面糖鎖
がん腫瘍の細胞を細胞接着不全状態にできれば、抗がん剤が腫瘍の深部まで浸透し劇的に治療効果が高まると考えられる。
細胞同士の接着は、正常細胞やがん細胞に関わりなく細胞表面糖鎖が重要な役割を果たしている。動物細胞の細胞接着は細胞膜同士が接着しているのではなく、細胞膜に埋め込まれたタンパク質や脂質に結合した糖鎖を介して細胞が接着している。つまり、細胞の表面は糖鎖に覆われていると言える(顕微鏡写真はこちら)。
本研究では、細胞接着に関わる細胞膜に埋め込まれたタンパク質と脂質上の糖鎖のうち、タンパク質糖鎖を研究対象とする。タンパク質糖鎖は、N-型糖鎖とO-型糖鎖の二種類がある。それぞれの特徴を下にまとめた。
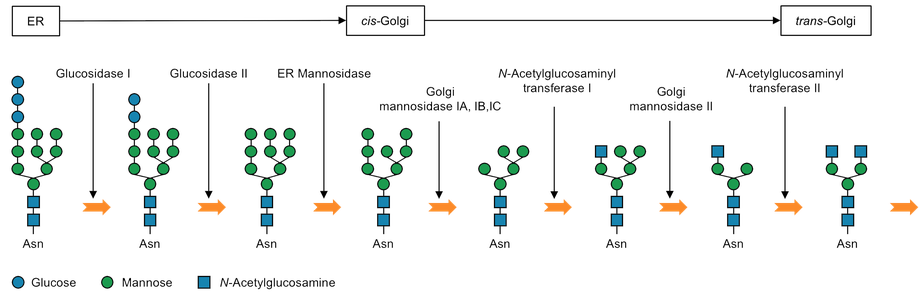
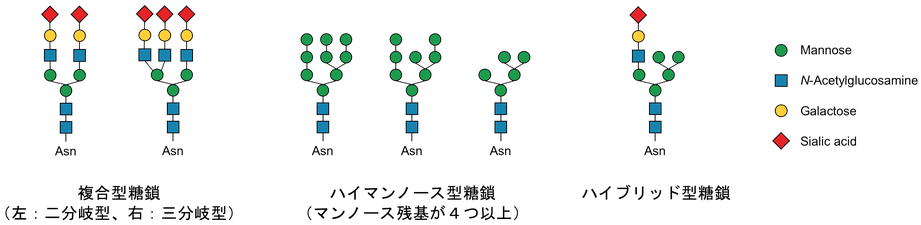
- N-型糖鎖:タンパク質のアスパラギン(Asn, N)残基の側鎖末端のアミド窒素原子に糖鎖が結合する。糖鎖が結合するアスパラギン残基のタンパク質中のアミノ酸配列は、Asn-X-Ser/Thr(Xはプロリン以外の任意のアミノ酸残基)となる。この配列をコンセンサス配列とよぶ。N-型糖鎖は、複合型・ハイマンノース型・その両方の糖鎖様式を持つハイブリッド型の3種類からなる(下図参照)。
- O-型糖鎖:タンパク質のセリン(Ser, S)あるいはスレオニン(Thr, T)側鎖の酸素原子に糖鎖が結合する。特定のコンセンサス配列を持たない。
細胞接着不全とゴルジマンノシダーゼ阻害剤
動物細胞の表面には様々な種類の複合型糖鎖やハイブリッド型糖鎖が存在し細胞接着に関与している。このような細胞接着に関与するN-型糖鎖の構築プロセスの初期過程を下図にまとめた。
本研究の目的とする細胞接着不全を達成するためには、ゴルジマンノシダーゼ(IA, IB, IC, and II)の阻害が有効である。これらの酵素を阻害すると細胞表面糖鎖が本来細胞表面に存在しないハイマンノース型糖鎖となり細胞接着不全を引き起こす。そこで、天然有機化合物ライブラリよりゴルジマンノシダーゼ阻害剤を探索し有用な阻害剤を発見した。現在、固形がん腫瘍のモデルとして卵巣がん細胞(OVCAR-3)スフェロイドを用い、スフェロイド崩壊活性を指標として阻害剤の活性向上を目指している。